小罗碎碎念
该研究首次发现在同期放化疗基础上增加特瑞普利单抗(PD-1抗体)新辅助和辅助治疗显著提高了高危局部晚期鼻咽癌患者生存率。
如果大家看完这篇推送以后,有什么好的医工交叉点子,欢迎和我一起探讨!(因为……说不定我可以帮你联系到一作呢,哈哈)

| 角色 | 姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | Sai-Lan Liu | 中山大学肿瘤中心 |
| 第一作者 | Xiao-Yun Li | 中山大学肿瘤中心 |
| 第一作者 | Jin-Hao Yang | 中山大学肿瘤中心 |
| 第一作者 | Dong-Xiang Wen | 中山大学肿瘤中心 |
| 第一作者 | Shan-Shan Guo | 中山大学肿瘤中心 |
| 第一作者 | Li-Ting Liu | 中山大学肿瘤中心 |
| 第一作者 | Yi-Fu Li | 中山大学肿瘤中心 |
| 通讯作者 | Hai-Qiang Mai | 中山大学肿瘤中心 |
研究对象为18至65岁的新诊断高危III-IVa期局部晚期鼻咽癌成人患者,这些患者治疗前血浆EBV DNA浓度至少为1500拷贝/mL,且东部肿瘤协作组(ECOG)表现评分为0-1。患者随机分配(2:1)接受toripalimab或安慰剂的新辅助和辅助疗法,以及同期顺铂化疗和调强放疗。
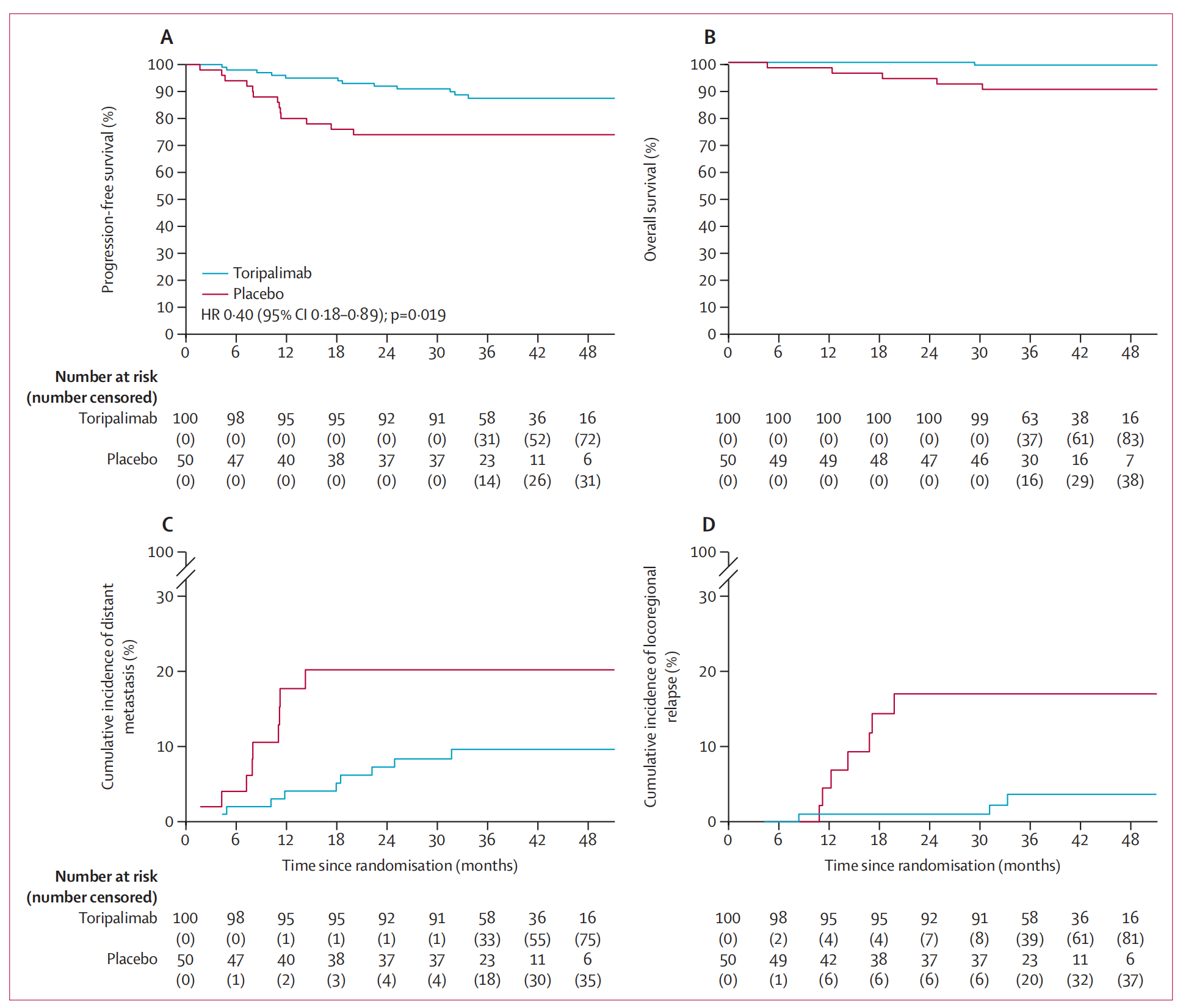
主要终点是意向治疗人群的2年无进展生存率。研究结果显示,toripalimab组的2年无进展生存率(92.0%)高于安慰剂组(74.0%),风险比为0.40,具有统计学意义(p=0.019)。在安全性方面,toripalimab组和安慰剂组的3级或更严重的急性不良事件(在随机化后一年内发生)包括白细胞减少症、粘膜炎、中性粒细胞减少症、贫血和体重减轻。免疫介导的3级或更严重不良事件仅在toripalimab组的10%患者中发生。安慰剂组中有1名患者死于与治疗无关的败血症性休克。
研究结果表明,toripalimab在新辅助和辅助阶段与同期放化疗联合使用可能是一种非常有前景的治疗方法。
一、背景介绍
鼻咽癌具有极为广泛的种族和地理分布特征,与Epstein–Barr病毒(EBV)感染密切相关。
当前,顺铂为基础的同步放化疗是局部区域晚期鼻咽癌的标准治疗策略。然而,约30%的鼻咽癌患者易出现局部区域复发或远处转移,尤其是具有高危因素的患者,如T4或N2–3疾病或治疗前血浆EBV DNA浓度高的患者,被认为是临床试验的理想候选人。
值得注意的是,2023年发表的一篇荟萃分析为系统性强化治疗策略在提高局部区域晚期鼻咽癌患者生存率方面的有效性提供了证据。尽管如此,关于在同步放化疗中增加辅助化疗或新辅助化疗对高危患者的益处仍存在争议。
此外,实体肿瘤中含有在化疗后存活的持续细胞,这些细胞会导致肿瘤进展和不良预后。因此,迫切需要新的治疗手段来治疗高危鼻咽癌。
免疫治疗作为一种治疗多种类型癌症的方法,因其普遍耐受性良好和高度疗效而受到广泛关注。
由于鼻咽癌中存在丰富的淋巴细胞浸润、PD-L1高表达以及多种免疫靶点,因此将免疫治疗纳入鼻咽癌治疗具有充分的生物学依据。
作者之前的III期临床试验表明,与单纯化疗相比,采用toripalimab进行免疫检查点阻断作为复发或转移性鼻咽癌的一线治疗,可提高生存率,同时保持可控的安全性能。两项独立的III期试验也报告了类似结果。此外,免疫检查点阻断单药治疗作为复发或转移性鼻咽癌的二线或后线治疗也显示了显著疗效。
然而,免疫检查点阻断在局部区域晚期鼻咽癌中的使用顺序尚不明确。将PD-1阻断剂加入同步放化疗治疗头颈部癌症的尝试并未带来生存益处,这可能是由于放疗对T细胞功能障碍、T细胞耗竭或肿瘤微环境改变的影响,这些因素可能阻碍免疫能力。
先前的研究表明,与标准同步放化疗相比,同步放化疗后采用免疫检查点阻断治疗作为巩固或维持治疗,可增强系统性免疫监视并消除微残留疾病,从而提高总生存率。
此外,研究提示在新辅助治疗背景下使用免疫检查点阻断可能扩大并激活肿瘤特异性T细胞,同时保留原发肿瘤并消除微转移。
在之前的研究中,采用新辅助和辅助免疫治疗联合放疗治疗各种恶性肿瘤患者取得了临床意义显著的结果。
Toripalimab,一种针对人PD-1的人源化IgG4κ单克隆抗体,已被证明可改善复发或转移性鼻咽癌患者的预后,美国食品和药物管理局于2023年10月27日批准该药物用于复发或转移性鼻咽癌的所有线治疗。
本研究启动时,根据国家综合癌症网络指南的2级证据,推荐局部区域晚期鼻咽癌患者接受同步放化疗加辅助化疗、新辅助化疗加同步放化疗或仅同步放化疗。先前的一项网络荟萃分析显示,同步放化疗与更强化治疗(同步放化疗加辅助化疗或新辅助化疗加同步放化疗)具有相同的疗效,因此同步放化疗应作为局部晚期鼻咽癌的首选治疗。
在本研究中,作者比较了同步放化疗联合toripalimab或安慰剂作为新辅助和辅助治疗,对于具有复发和转移高风险(III–IVa期和治疗前血浆EBV DNA浓度≥1500 copies/mL)的鼻咽癌患者的疗效和安全性。
二、研究动机
在过往的医学研究中,科学家们已经发现,在放疗开始之前,通过引入PD-1单克隆抗体(PD-1单抗)作为新辅助治疗,能够有效地激活患者体内的抗肿瘤免疫反应。这种激活作用不仅能够促进肿瘤特异性T细胞对原发肿瘤的杀伤作用,而且这些活化的T细胞还能在体内迁移,寻找并消灭那些微小的、远处的肿瘤转移灶。
此外,在放化疗的同时期,如果在辅助阶段加入PD-1单抗治疗,可以进一步增强机体的免疫监视功能,帮助清除鼻咽部位的残留肿瘤细胞以及远处的微小转移灶,从而减少肿瘤的复发和转移,改善局部晚期鼻咽癌患者的预后和生存质量。
然而,放疗过程中,对颈部淋巴结进行的大体积预防性照射可能会直接导致记忆性淋巴细胞的消除,这会削弱免疫治疗的效果。同时,辐射还可能改变肿瘤微环境,从而降低PD-1单抗的抗肿瘤免疫反应。鉴于这些因素,本研究在同期放化疗阶段选择不联合使用PD-1单抗,以避免可能的负面效应。
通过血浆中EB病毒DNA(EBV DNA)的检测,可以筛选出预后较差的局部区域晚期鼻咽癌患者。对于这部分高危患者,如果在同期放化疗的基础上增加PD-1单抗的新辅助和辅助治疗,即采用所谓的“免疫三明治”治疗模式,有望进一步提高他们的生存率。这种治疗模式结合了放疗、化疗和免疫治疗的优势,旨在通过不同阶段的治疗协同作用,达到最佳的治疗效果。
为了验证这一治疗策略的有效性和安全性,麦海强教授领导的研究团队发起了一项II期随机对照研究。这项研究旨在通过严谨的科学方法,评估“免疫三明治”治疗方案在提高局部区域晚期鼻咽癌患者生存率方面的潜力,并确保这种治疗方案的安全性和可行性。
三、临床试验流程图
下图描述了患者筛选、分组、治疗和随访的过程。
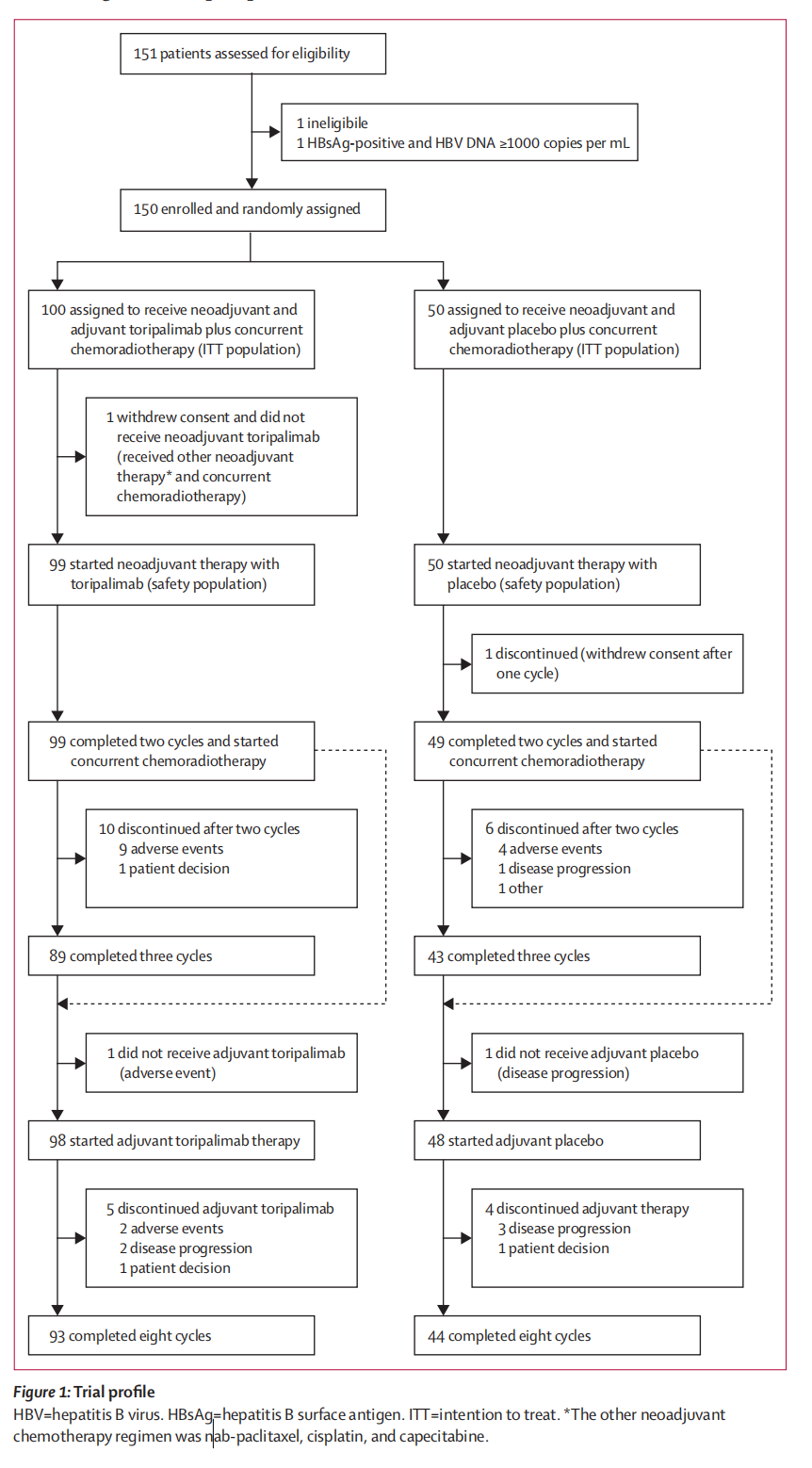
以下是对流程图的详细分析:
-
患者筛选和入组:
- 总共有151名患者被评估是否符合条件。
- 其中1名患者不符合条件,原因是HBsAg(乙型肝炎表面抗原)阳性且HBV DNA(乙型肝炎病毒DNA)≥1000拷贝/毫升。
- 剩下的150名患者被随机分配到两个治疗组:
- 100名患者被分配到接受新辅助和辅助的特瑞普利单抗(toripalimab)加上同步辅助安慰剂和同步化疗放疗(ITT人群)。
- 50名患者被分配到接受新辅助和辅助的特瑞普利单抗加上同步化疗放疗(ITT人群)。
-
治疗开始和中断:
- 在100名分配到特瑞普利单抗加安慰剂组的患者中,有1名患者撤回了同意并未接受新辅助特瑞普利单抗治疗,而是接受了其他新辅助化疗方案(纳布紫杉醇、顺铂和卡培他滨)和同步化疗放疗。
- 剩下的99名患者开始了新辅助特瑞普利单抗治疗(安全人群)。
- 在50名分配到特瑞普利单抗加化疗放疗组的患者中,所有50名患者都开始了新辅助特瑞普利单抗治疗(安全人群)。
- 在这两个组中,各有1名患者在一个周期后撤回同意,因此没有完成新辅助治疗。
-
治疗周期完成情况:
- 在特瑞普利单抗加安慰剂组中,有49名患者完成了两个周期的治疗并开始了同步化疗放疗,而有10名患者在接受两个周期后中断治疗,其中9名是因为不良事件,1名是因为疾病进展。
- 在特瑞普利单抗加化疗放疗组中,有43名患者完成了两个周期的治疗并开始了同步化疗放疗,而有6名患者在接受两个周期后中断治疗,其中4名是因为不良事件,2名是因为疾病进展。
-
完成治疗周期:
- 在特瑞普利单抗加安慰剂组中,有89名患者完成了三个周期的治疗。
- 在特瑞普利单抗加化疗放疗组中,有43名患者完成了三个周期的治疗。
-
辅助治疗开始和中断:
- 在特瑞普利单抗加安慰剂组中,有98名患者开始了辅助特瑞普利单抗治疗,但有4名患者中断了辅助治疗,其中2名是因为不良事件,2名是因为疾病进展,1名是因为患者决定。
- 在特瑞普利单抗加化疗放疗组中,有48名患者开始了辅助安慰剂治疗,但有5名患者中断了辅助治疗,其中3名是因为不良事件,2名是因为疾病进展,1名是因为患者决定。
-
完成辅助治疗周期:
- 在特瑞普利单抗加安慰剂组中,有93名患者完成了八个周期的治疗。
- 在特瑞普利单抗加化疗放疗组中,有44名患者完成了八个周期的治疗。
四、基线数据
特瑞普利单抗(Toripalimab)组和安慰剂(Placebo)组在该临床试验中的基线特征数据。
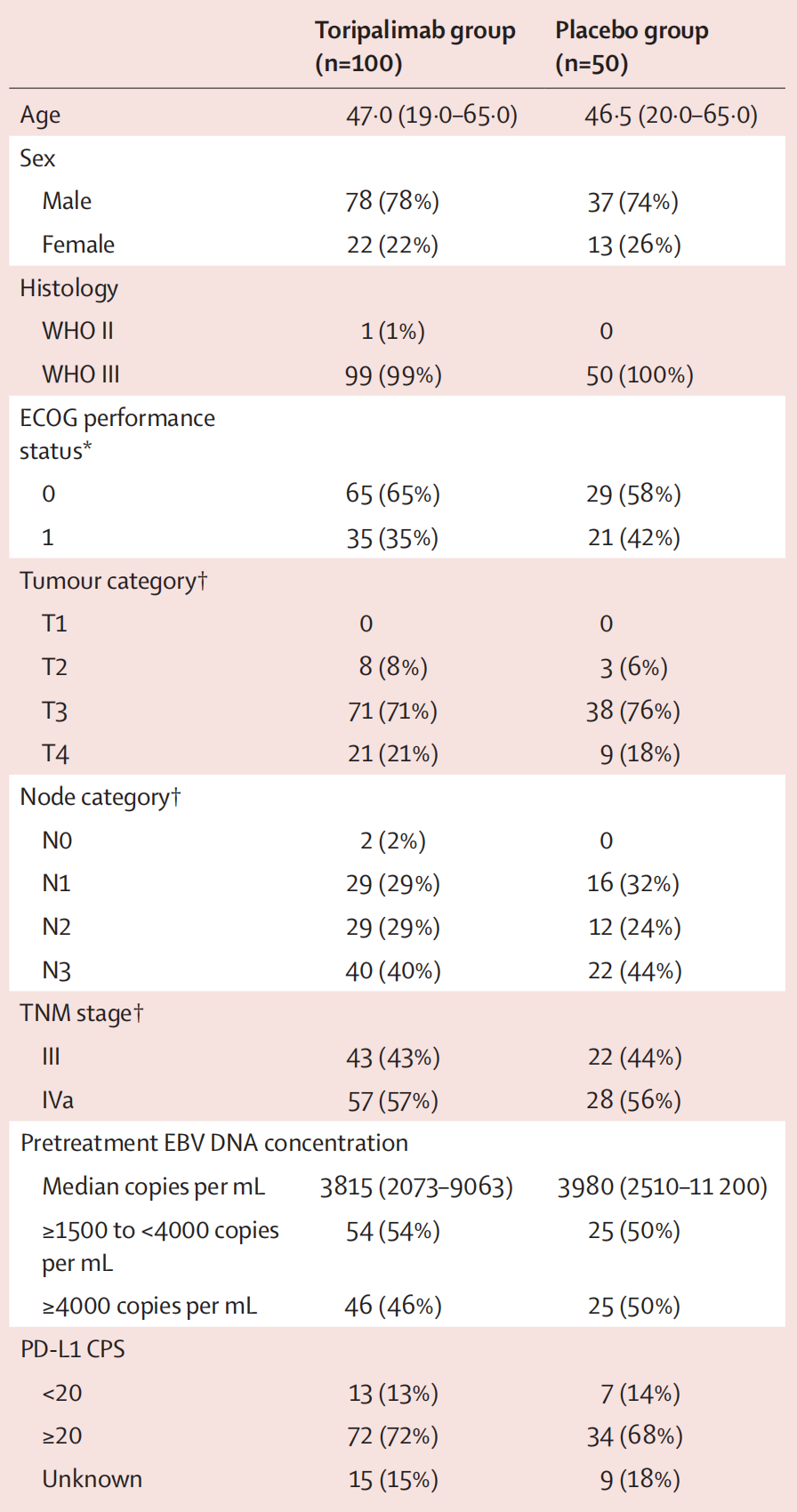
以下是对这些数据的详细分析:
1. 患者人数
- 特瑞普利单抗组:100名患者
- 安慰剂组:50名患者
2. 年龄
- 特瑞普利单抗组:平均年龄47.0岁,年龄范围19.0-65.0岁
- 安慰剂组:平均年龄46.5岁,年龄范围20.0-65.0岁
3. 性别
- 男性:
- 特瑞普利单抗组:78名(78%)
- 安慰剂组:37名(74%)
- 女性:
- 特瑞普利单抗组:22名(22%)
- 安慰剂组:13名(26%)
4. 组织学类型
- WHO II:
- 特瑞普利单抗组:1名(1%)
- 安慰剂组:0名
- WHO III:
- 特瑞普利单抗组:99名(99%)
- 安慰剂组:50名(100%)
5. ECOG表现状态
- 0:
- 特瑞普利单抗组:65名(65%)
- 安慰剂组:29名(58%)
- 1:
- 特瑞普利单抗组:35名(35%)
- 安慰剂组:21名(42%)
6. 肿瘤类别
- T1:
- 特瑞普利单抗组:0名
- 安慰剂组:0名
- T2:
- 特瑞普利单抗组:8名(8%)
- 安慰剂组:3名(6%)
- T3:
- 特瑞普利单抗组:71名(71%)
- 安慰剂组:38名(76%)
- T4:
- 特瑞普利单抗组:21名(21%)
- 安慰剂组:9名(18%)
7. 淋巴结类别
- N0:
- 特瑞普利单抗组:2名(2%)
- 安慰剂组:0名
- N1:
- 特瑞普利单抗组:29名(29%)
- 安慰剂组:16名(32%)
- N2:
- 特瑞普利单抗组:29名(29%)
- 安慰剂组:12名(24%)
- N3:
- 特瑞普利单抗组:40名(40%)
- 安慰剂组:22名(44%)
8. TNM分期
- III:
- 特瑞普利单抗组:43名(43%)
- 安慰剂组:22名(44%)
- IVa:
- 特瑞普利单抗组:57名(57%)
- 安慰剂组:28名(56%)
9. 预处理EBV DNA浓度
- 中位数拷贝数/毫升:
- 特瑞普利单抗组:3815(范围2073-9063)
- 安慰剂组:3980(范围2510-11200)
- ≥1500到<4000拷贝/毫升:
- 特瑞普利单抗组:54名(54%)
- 安慰剂组:25名(50%)
- ≥4000拷贝/毫升:
- 特瑞普利单抗组:46名(46%)
- 安慰剂组:25名(50%)
10. PD-L1 CPS
- <20:
- 特瑞普利单抗组:13名(13%)
- 安慰剂组:7名(14%)
- ≥20:
- 特瑞普利单抗组:72名(72%)
- 安慰剂组:34名(68%)
- 未知:
- 特瑞普利单抗组:15名(15%)
- 安慰剂组:9名(18%)
分析总结
- 两组在年龄、性别、组织学类型、ECOG表现状态、肿瘤类别、淋巴结类别、TNM分期、EBV DNA浓度和PD-L1 CPS方面都相对平衡,这有助于减少偏差,使得研究结果更具可比性。
- 特瑞普利单抗组和安慰剂组在大多数基线特征上相似,这表明随机化分组是成功的,为后续疗效和安全性分析提供了坚实的基础。
- 两组中WHO III型肿瘤患者占绝大多数,这可能与鼻咽癌的病理特征有关。
- 两组中大多数患者的PD-L1 CPS≥20,这可能与特瑞普利单抗的疗效有关,因为PD-L1的表达水平可能影响免疫检查点抑制剂的疗效。
这些基线特征数据对于理解研究人群的构成和评估治疗效果至关重要。
五、临床结局和响应
特瑞普利单抗(Toripalimab)组和安慰剂(Placebo)组在该临床试验中的临床结果数据。
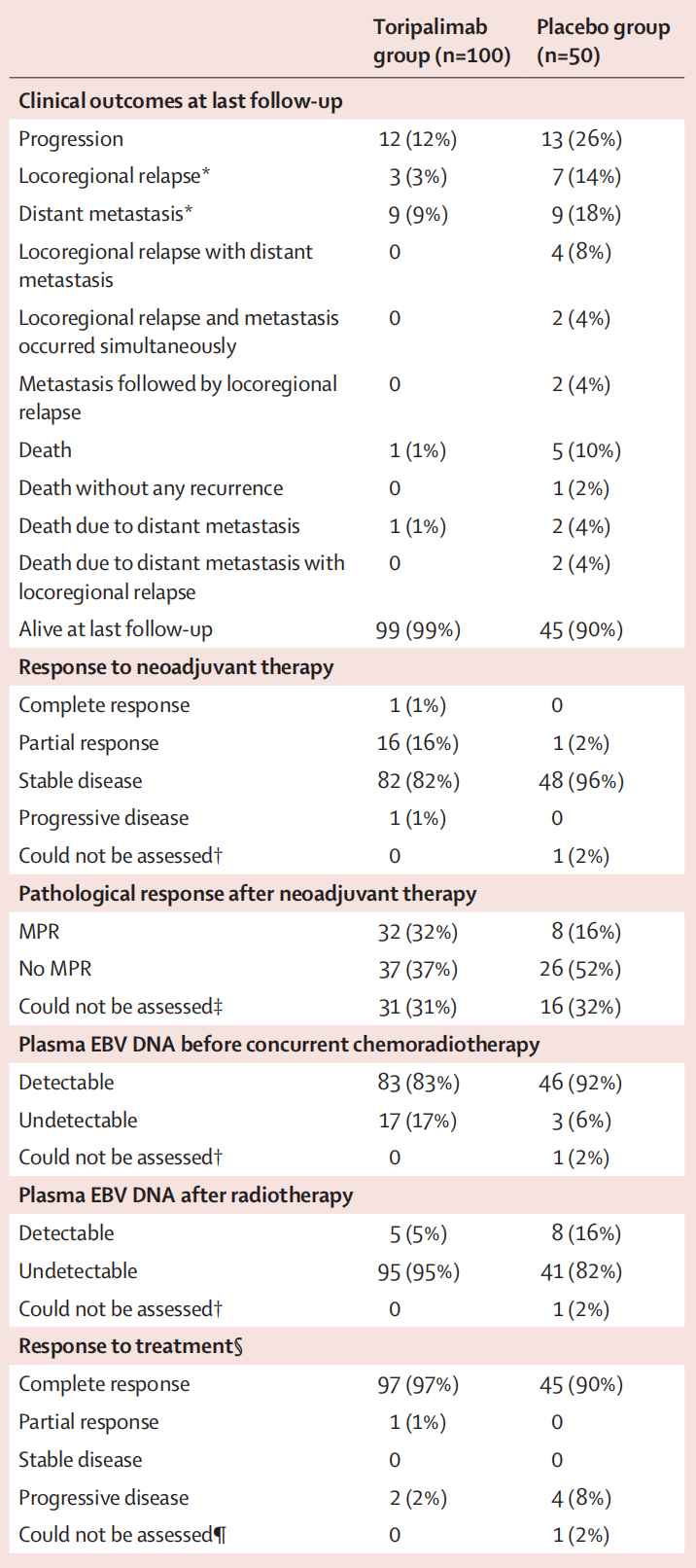
以下是对这些数据的详细分析:
1. 临床结果
- 疾病进展:
- 特瑞普利单抗组:12名(12%)
- 安慰剂组:13名(26%)
- 局部区域复发:
- 特瑞普利单抗组:3名(3%)
- 安慰剂组:7名(14%)
- 远处转移:
- 特瑞普利单抗组:9名(9%)
- 安慰剂组:9名(18%)
- 局部区域复发伴随远处转移:
- 特瑞普利单抗组:0名
- 安慰剂组:4名(8%)
- 局部区域复发和远处转移同时发生:
- 特瑞普利单抗组:0名
- 安慰剂组:2名(4%)
- 远处转移后局部区域复发:
- 特瑞普利单抗组:0名
- 安慰剂组:2名(4%)
- 死亡:
- 特瑞普利单抗组:1名(1%)
- 安慰剂组:5名(10%)
- 无复发死亡:
- 特瑞普利单抗组:0名
- 安慰剂组:1名(2%)
- 因远处转移死亡:
- 特瑞普利单抗组:1名(1%)
- 安慰剂组:2名(4%)
- 因远处转移伴随局部区域复发死亡:
- 特瑞普利单抗组:0名
- 安慰剂组:2名(4%)
- 最后随访时存活:
- 特瑞普利单抗组:99名(99%)
- 安慰剂组:45名(90%)
2. 新辅助治疗反应
- 完全反应:
- 特瑞普利单抗组:1名(1%)
- 安慰剂组:0名
- 部分反应:
- 特瑞普利单抗组:16名(16%)
- 安慰剂组:1名(2%)
- 稳定疾病:
- 特瑞普利单抗组:82名(82%)
- 安慰剂组:48名(96%)
- 进展疾病:
- 特瑞普利单抗组:1名(1%)
- 安慰剂组:0名
- 无法评估:
- 特瑞普利单抗组:0名
- 安慰剂组:1名(2%)
3. 新辅助治疗后的病理反应
- MPR(主要病理反应):
- 特瑞普利单抗组:32名(32%)
- 安慰剂组:8名(16%)
- 无MPR:
- 特瑞普利单抗组:37名(37%)
- 安慰剂组:26名(52%)
- 无法评估:
- 特瑞普利单抗组:31名(31%)
- 安慰剂组:16名(32%)
4. 同步放化疗前的血浆EBV DNA
- 可检测:
- 特瑞普利单抗组:83名(83%)
- 安慰剂组:46名(92%)
- 不可检测:
- 特瑞普利单抗组:17名(17%)
- 安慰剂组:3名(6%)
- 无法评估:
- 特瑞普利单抗组:0名
- 安慰剂组:1名(2%)
5. 放疗后的血浆EBV DNA
- 可检测:
- 特瑞普利单抗组:5名(5%)
- 安慰剂组:8名(16%)
- 不可检测:
- 特瑞普利单抗组:95名(95%)
- 安慰剂组:41名(82%)
- 无法评估:
- 特瑞普利单抗组:0名
- 安慰剂组:1名(2%)
6. 治疗反应
- 完全反应:
- 特瑞普利单抗组:97名(97%)
- 安慰剂组:45名(90%)
- 部分反应:
- 特瑞普利单抗组:1名(1%)
- 安慰剂组:0名
- 稳定疾病:
- 特瑞普利单抗组:0名
- 安慰剂组:0名
- 进展疾病:
- 特瑞普利单抗组:2名(2%)
- 安慰剂组:4名(8%)
- 无法评估:
- 特瑞普利单抗组:0名
- 安慰剂组:1名(2%)
分析总结
- 特瑞普利单抗组在疾病进展、局部区域复发、远处转移、死亡等方面均显示出较低的发生率,表明特瑞普利单抗可能提高了治疗效果。
- 新辅助治疗反应显示,特瑞普利单抗组的部分反应和病理反应(MPR)率更高,这可能与更好的临床结果相关。
- 血浆EBV DNA的可检测性在特瑞普利单抗组中较低,这可能表明特瑞普利单抗在降低病毒载量方面更有效。
- 治疗反应显示,特瑞普利单抗组的完全反应率更高,而进展疾病率较低,进一步支持了特瑞普利单抗的疗效。
这些数据表明,特瑞普利单抗可能为鼻咽癌患者提供了更好的治疗效果和生存率。
六、Kaplan-Meier曲线图
无进展生存(Progression-free survival, PFS)、远处转移累积发生率(Cumulative incidence of distant metastasis)和局部区域复发累积发生率(Cumulative incidence of locoregional relapse)以及总生存(Overall survival, OS)的Kaplan-Meier曲线图